在癌症治疗领域,表皮生长因子受体抑制剂(EGFRi)是一把 “双刃剑”—— 它能精准阻断肿瘤细胞的生长信号,显著延长肺癌、结直肠癌等患者的生存期,但高达60%-90%的用药者会出现皮疹副作用,严重时需减量甚至停药,大大影响治疗效果与患者生活质量。
要解决这一临床痛点,就需要先弄清EGFRi诱发皮疹的机制,而EGFRi诱导SD大鼠皮疹模型正是科研人员探索这一问题的核心工具。
模型选择的科学逻辑
一、为什么要研究 “EGFRi 相关皮疹”?
表皮生长因子受体(EGFR)不仅存在于肿瘤细胞中,还广泛分布在正常皮肤的表皮细胞、毛囊上皮细胞中,负责调控皮肤屏障修复、毛囊生长等生理过程。当EGFRi抑制肿瘤细胞EGFR的同时,也会 “误伤” 皮肤中的 EGFR,导致:
• 皮肤屏障功能受损:表皮细胞增殖减慢、分化异常,皮肤变得脆弱易受刺激;
• 炎症反应激活:免疫细胞聚集,释放炎症因子(如IL-6、TNF-α),引发红肿、瘙痒;
• 毛囊异常:毛囊角化紊乱,出现粉刺样皮疹。
临床中,EGFRi 相关皮疹多在用药后1-2周出现,好发于面部、胸背部,表现为红斑、丘疹、脓疱,严重时伴随剧烈瘙痒、脱皮,甚至继发感染。但由于个体差异大,临床研究难以精准控制变量,因此需要借助动物模型,在标准化条件下探索皮疹的发生机制与治疗方案 —— 这就是SD大鼠皮疹模型的核心价值。
二、为什么选择SD大鼠?
要测试他克莫司软膏的效果,首先得有一个 “靠谱的皮疹模型”。选SD大鼠的3个关键原因:
• 皮肤结构接近人类:SD大鼠的表皮厚度、毛囊密度与人类皮肤相似度高,皮疹发生的病理过程(如表皮增厚、炎性细胞浸润)和人类EGFRi相关皮疹高度一致;
• 模型稳定性强:同一批次的 SD 大鼠遗传背景、体重、健康状态相近,用EGFRi诱导皮疹时,出现的时间、严重程度更统一,实验数据更可靠;
• 操作便利性高:SD大鼠体型适中(成年体重 200-300g),方便涂抹药膏、观察皮疹变化,也便于后续采集皮肤组织做病理分析。
三、如何让SD大鼠 “患上” 皮疹?
要成功构建模型,需要严格控制 “药物选择、给药方案、观察指标” 三大核心环节。目前科研中常用的建模流程如下,可供相关领域研究者参考:
1. 实验准备:大鼠与药物选择
• 实验动物:通常选用6-8周龄的雌性SD大鼠(雌性大鼠皮肤对EGFRi更敏感,皮疹发生率更高),体重200-220g,饲养环境控制在温度22-25℃、湿度50%-60%,适应性饲养1周后开始实验。
• EGFRi 药物:常用临床获批药物,如厄洛替尼(Erlotinib)、吉非替尼(Gefitinib)或西妥昔单抗(Cetuximab)。其中厄洛替尼因水溶性较好、大鼠皮疹诱导率高(可达80%以上),是最常用的建模药物。
2. 给药方案:精准控制剂量与周期
给药途径和剂量是模型成功的关键。目前主流方案有两种:
• 腹腔注射给药:将厄洛替尼用生理盐水(或含少量DMSO助溶)配制成浓度为 10-20mg/kg的药液,每日1次腹腔注射,连续给药14-21天。这种方式药物吸收稳定,能快速达到血药浓度,通常在给药 7-10 天后出现明显皮疹。
• 灌胃给药:若模拟临床口服给药场景,可将厄洛替尼混入大鼠饲料或制成混悬液灌胃,剂量稍高(20-30mg/kg),给药周期 21-28 天,皮疹出现时间略晚于腹腔注射,但更贴近临床用药方式。
凯斯艾生物皮肤疾病药理药效学评价平台
EGFRi 诱导 SD 大鼠皮疹模型案例分享
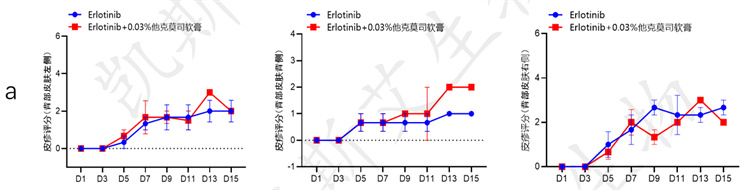
01 Erlotinib诱导大鼠皮疹模型及药效
数据展示
• 皮疹等级评分
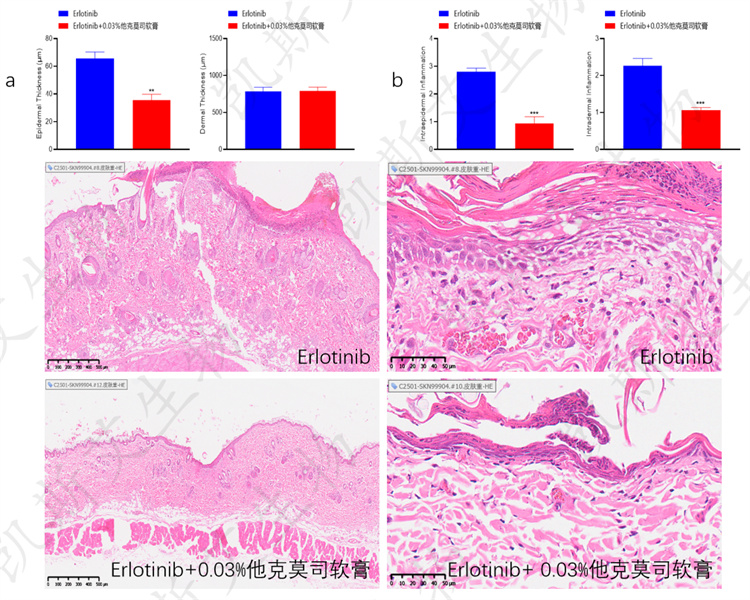
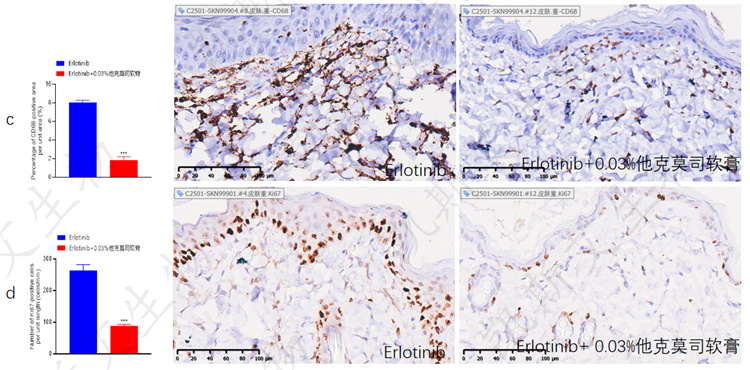
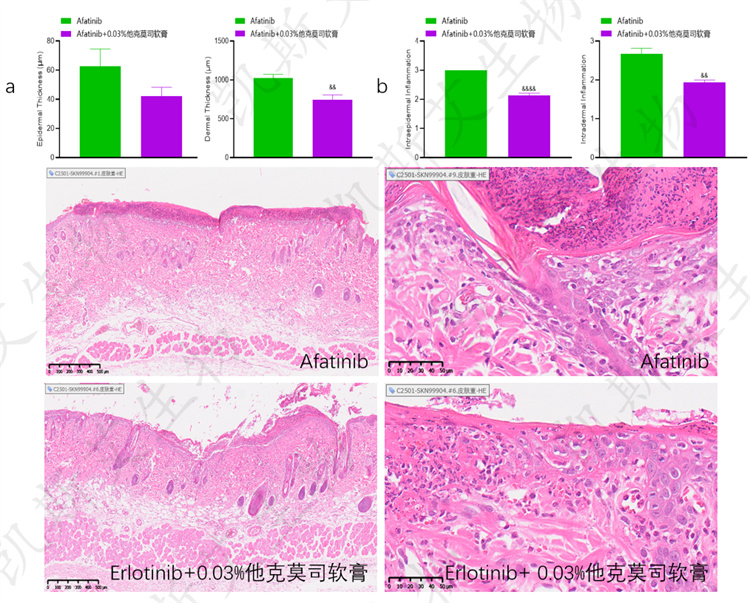
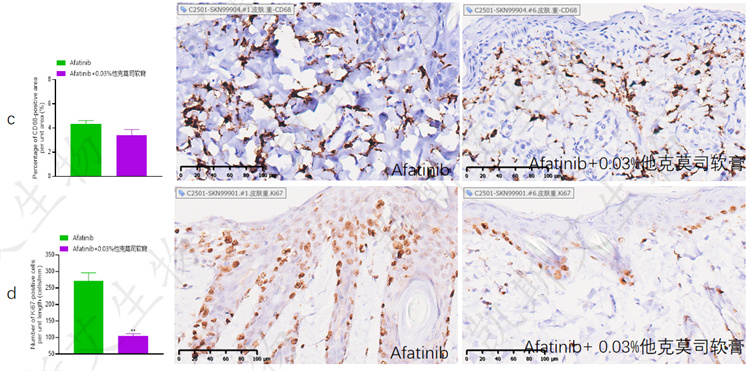
• a-组织病理检测表皮和真皮厚度、b-组织病理检测表皮和真皮内炎症、c-IHC-CD68、d-IHC-ki67
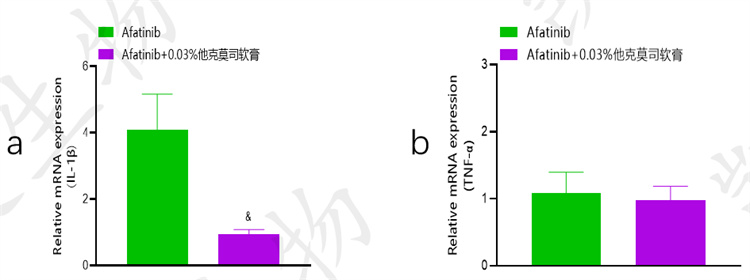
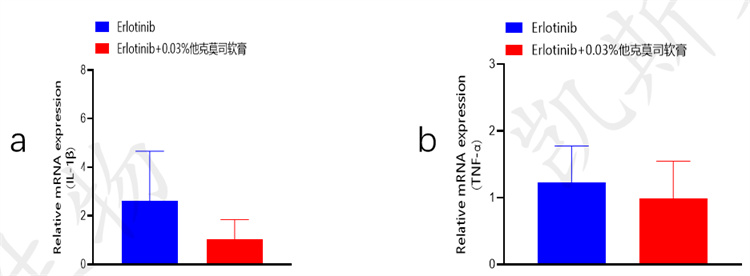
• a-qPCR-IL-1β、b-qPCR-TNF-α
02 Afatinib诱导大鼠皮疹模型
数据展示
• 皮疹等级评分
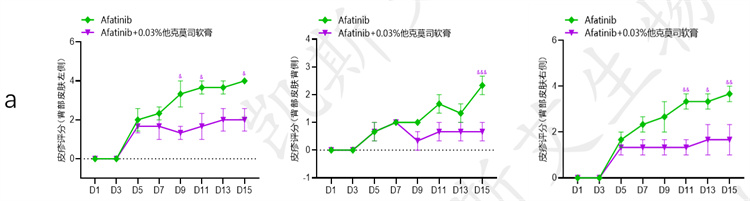
• a-组织病理检测表皮和真皮厚度、b-组织病理检测表皮和真皮内炎症、c-IHC-CD68、d-IHC-ki67
• qPCR